תהליך איזוכורי
תהליך איזוכורי (מיוונית עתיקה ἴσος ("איזוס") "שווה", ו-χώρα (חורה) "מרחב") הוא תהליך תרמודינמי בו הנפח נשאר קבוע. בתהליך איזוכורי לא מתבצעת עבודה.
בדיאגרמת מסלול של תהליך איזוכורי נקרא איזוכורה. סימן מזהה של איזוכורה הוא שהיא מקבילה לציר הלחץ () ולא נוטה ימינה או שמאלה (אחרת נקבל שינוי בנפח - ).
מאפיינים
תהליך איזוכורי מתאפיין בנפח קבוע (עבור חישובים דיפרנציאלים[1] ). נהוג לציין שתהליכים כאלו מתרחשים במערכת סגורה וקשיחה.
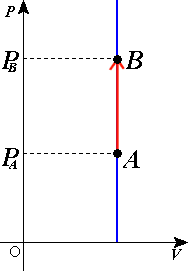
עבודה
בדיאגרמת השטח מתחת לעקומה יהיה העבודהתבנית:הערה שביצע הגז על הסביבה. בתהליך איזוכורי, הקו אנכי ולכן השטח תחת העקומה יהיה אפס. לכן .
אנרגיה פנימית
לפי החוק הראשון של התרמודינמיקה נקבל שהחום במערכת מועבר במלואו לאנרגיה הפנימית של המערכת: .
אנטרופיה
עבור גז אידיאלי בתהליך איזוכורי ניתן לחשב את השינוי באנטרופיה של המערכת:
קיבול חום
כל עוד גוף לא משנה את הפאזה שלו, קליטה או מסירה של חום משמשת לשינוי הטמפרטורה. קיבול חום מוגדר ככמות האנרגיה שיש להעביר לחומר בצורה של חום כדי להעלות את הטמפרטורה שלו בקלווין אחד.
כאשר רושמים נגזרת של פונקציה מרובת משתנים, חשוב לציין אילו משתנים מוחזקים קבועים. במקרה של גז, האבחנה הזאת היא מאוד חשובה.
תהליך איזוכורי
כל החום מומר להגדלת האנרגיה הפנימית (הטמפרטורה): .
נסמן:
תהליך איזוברי
בתהליך איזוברי חלק מהחום מומר לביצוע עבודה. המסקנה היא שצריך יותר חום כדי להעלות את הטמפרטורה בקלווין אחד אם התהליך הוא איזוברי.
נסמן:
דוגמאות
חימום מכל מתכתי עם גז בתוכו כאשר המכל אטום (אין דליפות) יהיה תהליך איזוכורי שבו הגז יגדיל את הלחץ והטמפרטורה אך הנפח יישאר קבוע.
דוגמה נוספת היא ניפוח בלון הליום. בדוגמה זו יש שינוי במספר החלקיקים אך התהליך עדיין איזוכורי מכיוון שהנפח לא משתנה.
ראו גם
קישורים חיצוניים
הערות שוליים
תבנית:הערות שוליים תבנית:תרמודינמיקה
- ↑ החישובים בערך זה נעשים בהנחה כי מדובר במערכת סגורה שבה מספר החלקיקים קבוע ().